-
基因组测序>
-
建库测序>
-
人类基因组测序>
-
动植物基因组测序>
-
微生物基因组测序>
-
-
转录调控测序>
-
表观组测序>
-
单细胞测序>
-
空间转录组>
-
基因分型>
-
质谱分析>
-
蛋白组学分析>
-
代谢组学分析>
-
血液蛋白质组分析>
-
免疫定量>
-
-
多组学联合分析>
-
分子育种>
-
基因合成>
CyTOF 质谱流式单细胞蛋白检测
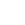
质谱流式技术催化了单细胞蛋白质组学的革命,是基于荧光流式的改良技术(Fig 1)。用重金属同位素标签代替传统流式荧光标签,利用质谱技术检测单个细胞全部待测Marker丰度与类型。该技术的应用一方面使流式检测通道数量大幅提高到40+,提升了单个样品获得的信息量;另一方面避免了通道间信号的干扰,大大简化了实验设计,提升了数据的可靠性。
通道的增加意味着可以对细胞亚型进行更精准的分群,也意味着可以对细胞内信号通路进行更加全面的分析;单次实验可捕获百万级别的单细胞,避免遗漏稀有亚群。
广度和深度的综合,适用于各种情况下生理,病理单细胞表型、信号通路及功能等研究。使得质谱流式成为单细胞水平蛋白组学研究不可或缺的工具。
 Fig 1 质谱流式示意图
Fig 1 质谱流式示意图
灵敏度高、应用范围广
Starion 质谱流式系统对信号分辨率极高,可同时检测40+不同的标签。质谱流式可以同时获得单细胞表面 Marker、胞内信号通路、转录因子、细胞因子、细胞周期等等各方面的信 息,在造血、免疫、干细胞、癌症以及药物筛选等多个领域的研究中有着广泛的应用。
科学方案设计
从抗体 Panel 设计到数据分析,每一步都经过科学、缜密的设计,以保障高质量研究成果。
常见问题
-
1. 传统流式和质谱流式有哪些不同之处?
(1)标签系统的不同:前者主要使用各种荧光基团作为抗体的标签,后者则使用各种金属元素作为标签。
(2)检测系统的不同:前者使用激光器和光电倍增管作为检测手段,而后者使用 ICP 质谱技术作为检测手段。 -
2. 质谱流式比传统流式有哪些优势?
(1)通道数量增加到上百个。ICP 质谱装置具有非常宽的原子量检测范围(75~209 Da),可以同时检测上百个不同的参数。 (2)通道间无干扰,无需计算补偿。
(3)采用独特的金属标签抗体。由于细胞本身不含这些作为标签的金属元素,没有传统流式的“自发荧光”,因此信号背景极低。
(4)多样化的数据处理方式,实现对样品的深入分析。 -
3. 质谱流式的样本如何制备?
质谱流式技术所需样本为单细胞悬液。下面的制备流程以 PBMC 为例:
(1)PBMC 细胞分离。推荐用肝素或者柠檬酸盐作为抗凝剂抽提全血,并在4小时内使用Ficoll 或者 Percol 密度梯度离心法分离出 PBMC。注意需要尽量去除红细胞;
(2)顺铂染色。顺铂可用于区分死活细胞,推荐加入1 uL 终浓度为5 uM 的顺铂,37℃孵育5分钟后加入2~5倍体积的 Cell Staining Buffer,中止反应。其后以300 g的转速离心5分钟,
弃上清后使用 Cell Staining Buffer 或细胞培养基重悬细胞;
(3)细胞刺激(可选)。将细胞转入培养箱培养15~30 min,随后使用相应刺激物进行分组刺激。刺激后的细胞转至离心管,离心后使用 Cell Staining Buffer 稀释至1 mL;
注:此步根据具体需要,短时间的信号通路刺激可以按上述步骤进行;如果做数小时的胞内 Cytokine,该步骤应该放在染顺铂之前。
(4)细胞固定。使用2× 的 fixation buffer(含3.2% PFA 的 PBS)进行固定;
(5)将固定后的样品保存在-80℃。
更详细的制备步骤请咨询当地销售
Copyright@2011-2025 All Rights Reserved 版权所有:北京诺禾致源科技股份有限公司 京ICP备15007085号-1